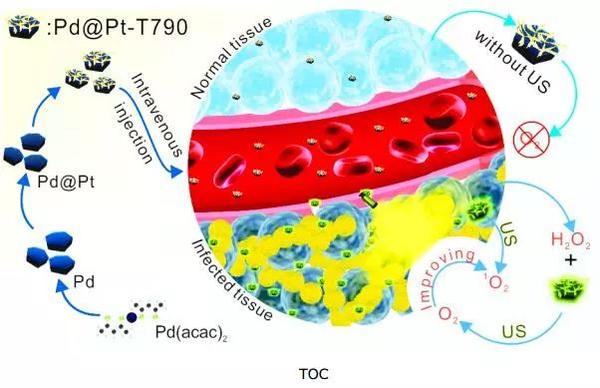
众所周知,目前主要是通过抗生素来治疗细菌感染性疾病,但是大量的使用抗生素出现了耐药性(MDR)物种,极大的降低了抗生素的治疗效果并导致很高的死亡率。如今,声动力学疗法(SDT)利用超声波(US)激活声敏剂产生活性氧(ROS)对各种MDR细菌具有很高的细胞毒性,且不会产生耐药性。然而,当前报道的大多数声敏剂(姜黄素等)都高度疏水,不利于其在血液中循环。此外,在激活过程中,O2的存在对于产生ROS至关重要。因此,细菌感染炎症部位的低氧微环境在很大程度上限制了SDT的治疗效果。更严重的是,SDT中氧气的快速消耗将极大加重缺氧现象,进一步降低SDT的疗效。因此,开发智能纳米系统以有效地将声敏剂输送到感染部位并同时缓解与缺氧相关的屏障是增强SDT疗效的一种新策略。根据研究发现,Au等贵金属纳米颗粒(NPs)可以作为产生ROS的纳米酶,从而对革兰氏阴性/阳性细菌都具有优异的抗菌性能。同时,这些纳米材料在水溶液中的分散性好、生物相容性好、较大的比表面积以及在病变处优异的累积能力而有望成为药物递送的载体。

基于此,厦门大学的郑南峰教授、刘刚教授和陈小兰副教授(共同通讯作者)联合报道了一种超声波可转换的纳米酶系统(Pd@Pt-T790),在超声波激活过程中可控制的催化产生氧气,助力产生ROS,从而降低了与低氧相关的屏障以增强了SDT的疗效。该纳米平台是由Pd@Pt纳米片与4(4-羧基苯基)卟啉(T790)连接制备的。在将T790修饰到Pd@Pt上可以显着的阻断Pd@Pt的活性,但在US照射下,纳米酶活性可以被有效的恢复,以催化内源性H2O2分解产生O2。这种阻断和激活纳米酶活性有助于降低其对正常组织的毒副作用,并有望实现活性可控和疾病位点特异性的纳米酶催化行为。利用Pd@Pt-T790在感染部位的出色积累和生物相容性,其可以消除耐甲氧西林金黄色葡萄球菌(MRSA)诱导的肌炎,以及有助于通过光声(PA)成像和磁共振成像(MRI)无创监测SDT的治疗。该工作为SDT治疗多药耐药细菌感染提供了一种新思路。
【图文解读】解析:通过PEG接头将T790修饰在Pd@Pt纳米片上而获得Pd@Pt-T790纳米平台(图1a),具有良好的生物相容性和较高的载药量。此外,共价结合可以避免T790在到达靶组织之前被提前释放。利用荧光、光声(PA)和计算机断层扫描(CT)成像,证实Pd@Pt-T790会在细菌感染的肌炎中有效累积。同时,在感染区氧合血红蛋白信号明显增强,证实了超声可转换酶催化产生O2。得益于自产生O2,Pd@Pt-T790的SDT功效被极大提高,可根除MRSA诱导的深层肌炎(图1b)。此外,通过PA成像和MRI成像原位监测了Pd@Pt-T790纳米酶系统的SDT进展。
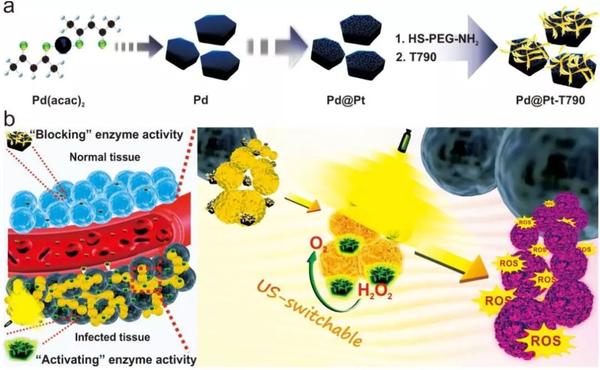
图1、Pd@Pt-T790的主要合成步骤及其细菌感染的US可切换纳米酶催化产生O2增强SDT的示意图。解析:从透射电子显微镜(TEM)图像中观察,所制备的Pd NSs的尺寸在50 nm左右。在Pd NSs上生长的Pt纳米点呈现岛状的形态(图2a),对比Pd NSs,制备的Pd@Pt的形貌和尺寸没有明显变化。通过高角度环形暗场扫描透射电子显微镜-能量色散X射线光谱(HAADF-STEM-EDX)进一步证实了Pd@Pt中Pd和Pt元素的存在(图2b)。在用SH-PEG-NH2和T790修饰Pd@Pt后,制备的Pd@Pt-T790的形貌没有重要变化(图2c)。Pd@Pt的流体动力学尺寸为44 nm,对于Pd@Pt-PEG变为59 nm,Pd@Pt-T790变为91 nm(图2d)。同样,Pd@Pt-T790的Zeta电位为-18.0 mV(图2e),比T790(-12.0 mV)和Pd@Pt-PEG(-13.5 mV)的负电位更大。此外,通过UV-Vis-NIR光谱(图2f)和荧光测量来证明T790被成功的修饰在Pd@Pt上。Pd@Pt-T790的吸收光谱不仅保留了Pd@Pt在NIR区域的宽吸收,而且有T790的特征吸收,最大吸收峰位于415 nm(图2f)。为了探究Pd@Pt-T790是否仍然保持催化H2O2生成O2性能,作者利用了一种溶解氧仪(JPBJ-608便携式溶解氧仪),在存在H2O2情况下体外监测Pd@Pt-T790产生的O2(图2g)。如图2g所示,Pd@Pt-T790+H2O2的几乎没有检测到生成O2,可能是由于T790的涂层影响了扩散,减少H2O2与Pd@Pt的接触。同时,还研究了pH对Pd@Pt-T790酶活性阻断的影响。发现Pd@Pt的活性强烈依赖于pH值。如图2h所示,单独的DCFH-DA,用H2O2或US辐射处理的DCFH-DA几乎没有荧光,表明产生的ROS可以忽略不计。同时,还研究了纳米酶增强SDT过程中
1
O2的产生。通过使用TEMP生成TEMPO自由基,并导致ESR信号分裂成特征性的1:1:1三联信号(图2i),可以看出对比TEMP+H2O2+US组,其他实验组均显示出1O2的特征信号增加。所有这些表明,US辐射不仅可以使声敏剂产生ROS,而且可以激活Pd@Pt-T790被阻断酶的活性,从而进一步增强SDT产生更多的ROS。
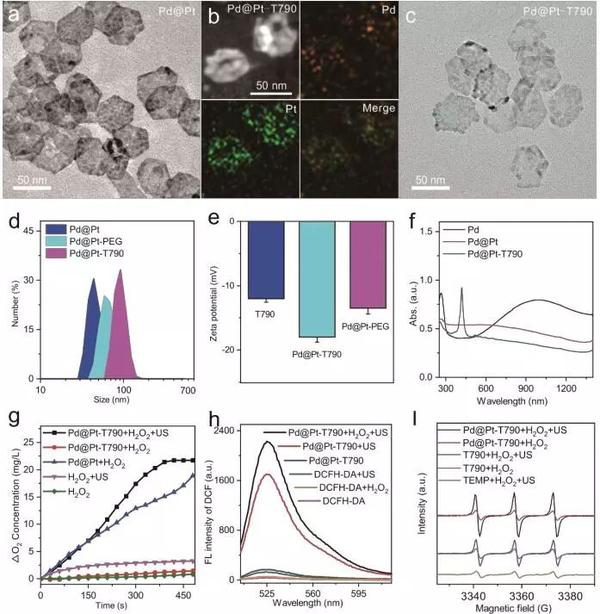
图2、Pd@Pt-T790的理化表征解析:作者利用临床分离的耐甲氧西林金黄色葡萄球菌(MRSA,革兰氏阳性细菌)作为模型细菌来测试Pd@Pt-T790的SDT的抗菌能力。如图3b所示,未在US辐射情况下,游离T790、Pd@Pt和Pd@Pt-T790处理的MRSA,其生长仍保持在70%以上,表明这些材料具有良好的生物相容性。仅接受超声处理的MRSA仍具有完整的形态和光滑的物体,但经过Pd@Pt-T790介导的SDT处理后,细菌的形状发生了重要变化。接着,作者利用激光共聚焦扫描显微镜(CLSM)进一步表征了Pd@Pt-T790的SDT抗菌作用。在未经US照射情况下,对照组、US、Pd@Pt和T790组中的细菌均发出绿色荧光,表明Pd@Pt-T790治疗组中所有细菌均活着,而一些死亡细菌(红色荧光)出现可能是由于Pd@Pt催化产生的O2增强了T790的光敏作用。在US活化后,Pd@Pt-T790治疗组的所有细菌均显示红色荧光,表明催化增强的SDT效应可诱导广泛的细菌死亡,但是分别用T790+US或Pd@Pt+US处理后,仍然有大量细菌存活(图3d)。结果表明,Pd@Pt-T790介导的SDT可以有效且迅速的破坏MRSA细菌,具有临床MRSA感染治疗的巨大潜力。
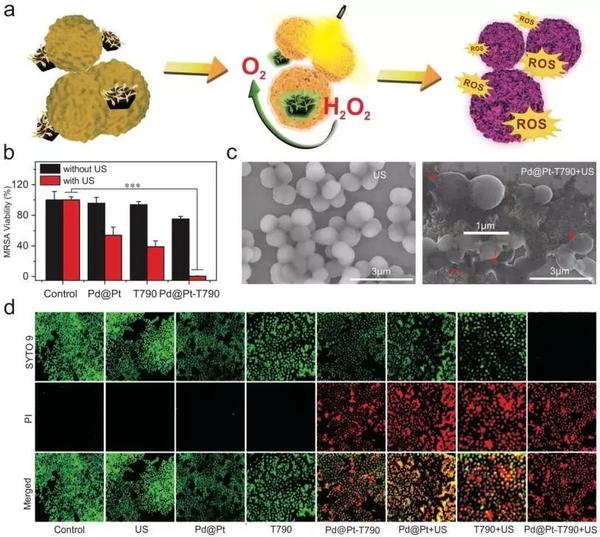
图3、Pd@Pt-T790的作用机制和细胞实验解析:为了测试Pd@Pt-T790在炎症部位是否也具有良好的累积效果,作者将在右大腿后部肌肉上具有MRSA感染的小鼠用作动物模型,并通过SH-PEG-NH2双功能试剂对Pd@Pt用Cy5.5-NHS修饰,以实时监控其累积效果。如图4a所示,静脉注射1 h后,[email protected]迅速累积到细菌感染部位,在注射6 h后达到最大值。半定量荧光分析进一步证实,[email protected]可以有效地在感染组织中积累,并且在注射6 h后达到最大值(图4b)。同样,Pd@Pt-T790仍然在感染部位表现出高积累,表明T790的修饰并没有改变Pd@Pt的体内行为。如图4c所示,Pd@Pt或Pd@Pt-T790在PA信号及其浓度之间呈现出几乎相同的线性关系,表明T790的修饰不会影响Pd@Pt和Pd@Pt-T790的PA成像能力。在静脉注射6 h后,Pd@Pt处理的小鼠感染部位周围的PA信号几乎是注射前的2倍(图4d,f)。此外,受感染的腿和正常腿之间的CT信号明显对比也表明,Pd@Pt在细菌感染的组织中有良好的积累(图4e,g)。综上所述,这些体内成像数据不仅表明Pd@Pt-T790可以有效地积累在感染部位,并将内源性H2O2分解成O2以增强T790的SDT功效,而且还证实了Pd@Pt-T790作为造影剂,可提供影像引导的感染治疗。
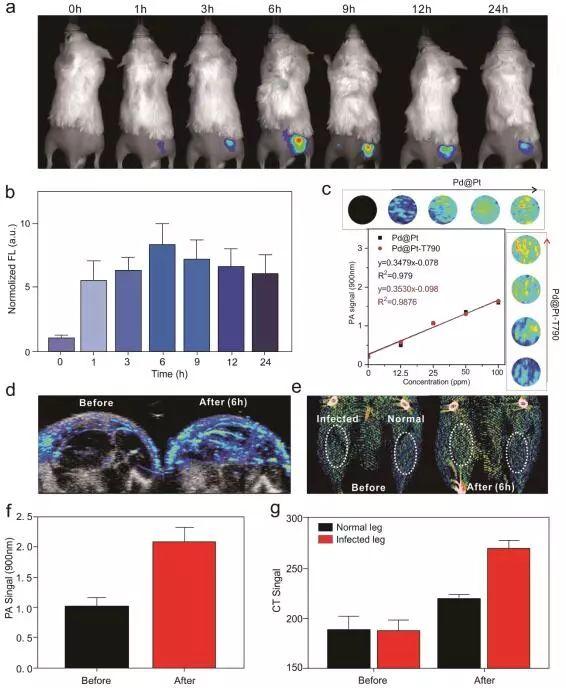
图4、Pd@Pt-T790的体内实验【小结】综上所述,作者成功的构建了Pd@Pt-T790纳米平台,并将其用于催化增强SDT来治疗MRSA感染的肌炎。制备的Pd@Pt-T790纳米平台具有以下优点:(1)T790与Pd@Pt纳米片的共价结合,保持了良好的稳定性并且避免被过早的释放;(2)制备的Pd@Pt-T790可通过EPR作用有效地积聚在深层细菌感染中,为SDT提供了良好的保证;(3)超声敏化剂T790的修饰可显着阻断Pd@Pt的纳米酶活性,而US辐射可有效激活Pd@Pt-T790的活性,从而降低了纳米酶对正常器官的潜在毒性,并提供了丰富的氧气源用于SDT诱导产生ROS,从而显着增强治疗效果;(4)该系统还具有荧光、PA显像和CT显像剂来指导消除感染的治疗过程;(5)MRI和光声氧合血红蛋白饱和度成像以实时监测治疗过程;(6)Pd@Pt-T790还具有优异的体内外生物相容性。制备的Pd@Pt-T790在US辐射下,在体内和体外可以完全根除细菌的感染。该工作不仅可以通过US可转换的催化产生氧气来增强SDT的功效,而且还提供了一种有效的治疗深层细菌感染的方式。本公众号建立了“肿瘤治疗交流群”,有兴趣添加小编微信(微信号:polymer-xiang),备注:名字-单位-职称-肿瘤治疗,一起参与群讨论。全文链接:https://pubs.acs.org/doi/10.1021/acsnano.9b08667
来源:高分子科学前沿
